本ホームページは、デューク大学医学部神経内科付属病院のホームページの中のRole of the Microbiomeを翻訳しています。素人が自分の治療と勉強のために訳したページですので、ご了承ください。
NTRODUCTION
ここでは、腸内細菌叢とALSの関連性について、これまでに分かっていることを紹介します。まだ新しい研究分野ですが、これまでの知見は有望であり、マイクロバイオームが神経変性疾患で果たす役割の理解に近づきつつあります。
第1節 腸疾患におけるマイクロバイオームとその役割
マイクロバイオーム

マイクロバイオームは、マイクロバイオータとも呼ばれ、私たちの体内や対外に生息する生物を指します。これには、細菌、ウイルス、寄生虫、真菌が含まれます。実際にはいくつかの異なるマイクロバイオームがあり、それらも人によっても異なり、さらには人の部位間でも異なります(Marks、2018)。
ここで焦点を当てるのは、私たちの胃腸(GI)管に生息する生物の集まりである腸内細菌叢です。それらについては1600年代から知られていましたが、ALSのような神経変性疾患におけるその潜在的な役割が解明された始めたのはごく最近のことです。
腸内細菌叢は、私たちのすべての微生物叢の中で最大かつ最も複雑で、推定37兆個の生物で構成されています。実際、これらの生物の数は私たちの体内のすべての細胞の数を上回っていることから、私たちを人間よりも非人間的なものにしてしまっているのです。さらに興味深いのは、これらの生物のほとんどではありませんが、一部を特定したことにあります。(GMFH編集チーム、2019年)。
なぜ腸内細菌叢があるのか?
腸内細菌叢が存在するのにはいくつかの理由がありますが、次の3つの領域で重要であると思われます。
栄養素代謝
脂肪、炭水化物、食物繊維を消化するのを助け、腸細胞にエネルギーを提供し、抗炎症作用をもたらします。
免疫
マイクロバイオームは、腸内の免疫だけでなく、全身の免疫にも役割を果たしているようです。
薬物および環境化学代謝
腸内細菌叢は、多環芳香族炭化水素(PAHs)などの特定の環境化学物質を体が処理するのを助けます。
(National Academies of Sciences, Engineering, and Medicine, 2018)
マイクロバイオームはどのように始まり、変化するのですか?
私たちのマイクロバイオームは、産道を通過するときに播種されると考えられています。そして、私たちの生活の中で、遺伝学、食事、服用する薬(特に抗生物質)、運動、ホルモン、病気、年齢によって変化する可能性があります(Davis、2018;Daliri et al., 2020)。
マイクロバイオームを研究するには?
マイクロバイオームは次の3つの方法で研究されています。
便サンプル
特定の病気を患っている人とそうでない人から糞便サンプルを採取することで、サンプル中の生物がどのように異なるかを比較できます(Cryan et al., 2020)。また、メタボリズムミックスと呼ばれる生物が代替物や化学物質を比較することもできます。
動物実験
無菌の抗生物質処理環境で動物を飼育し、さまざまな生物をマイクロバイオームに挿入して、行動がどのように変化するかを観察することができます。
マニピュレーション
私たちは、人々のマイクロバイオームを変えて、その影響を調べることができる2 つの方法があります。
糞便移植:患者の病気が改善することを期待して、健康な人の便を採取して、病気の人の腸に入れることを行います。これは次の方法で行われます。
- 便を飲み込めるカプセルにする
- 直腸からチューブを挿入して便を導入する
- 鼻から胃に挿入される経鼻胃管を使用して、便を直接胃に導入する(Wang、2018年)
プロバイオティクスとプレバイオティクス:これらは食品やサプリメントに含まれています。
- プロバイオティクスは、通常は細菌や酵母などの生きた生物で、私たちのマイクロバイオームを変化させることができます。ヨーグルト、ケフィア、バター、牛乳、チーズ、ザワークラウト、キムチ、サワードウパン、味噌、テンペ、コンブチャ、さらにはワインやビールなどの食品に含まれています。
- プレバイオティクスは、プロバイオティクスに含まれる生物の栄養源です。プレバイオティクスの優れた供給源には、チコリの根、アーティチョーク、タンポポ、ニンニク、ネギ、タマネギ、全粒小麦、果物、野菜、豆類が含まれます。(スビランド・エイブリー、2020年)
腸疾患におけるマイクロバイオームの役割
クロストリジウム・ディフィシル 大腸炎
腸内細菌叢は、激しい腹痛と下痢を特徴とするヒトの腸疾患であるクロストリジウム・ディフィシル大腸炎に関与していることが証明されています。これは、典型的には正常な腸内細菌叢に影響を与えた長期の病気や抗生物質による治療の後に、C.ディフィシルと呼ばれる細菌が過剰に増殖して発生します。C.ディフィシルは、腸に直接損傷を与え、炎症を引き起こす可能性のある毒素を産生します。
50年以上にわたり、C.ディフィシル大腸炎を糞便移植で治療してきましたが、現在では、糞便マイクロバイオーム移植で実際に治癒することを証明する複数のランダム試験が行われています。実際、他の種類の抗生物質などの従来の治療法よりも効果があると考えられます。糞便移植によるC.ディフィシル大腸炎の治癒率は90%を超えており、新鮮な便を使用するか冷凍された便を使用するか、便を上部消化管に入れるか下部消化管に入れるか、または1人のドナーから便を取得するか複数のドナーから採取するかどうかは関係ないよう思われます。ドナー便が適切にスクリーニングされている限り、これにはCOVID-19のスクリーニングも含まれるようになり、これらの患者にとってこれはかなり安全な手順であると考えられます。(Quraishi et al., 2017)。
炎症性腸疾患

これらは、クローン病や潰瘍性大腸炎など、腸に影響を与える全身性自己免疫疾患のグループです。腹痛や下痢に加えて、貧血、血球数の減少、血栓、関節、肺、皮膚の問題などの症状があります。これらは、免疫系を低下させる免疫抑制薬で治療される全身性疾患です。
これらの炎症性腸疾患を持つ人々は、そうでない人々とは異なる腸内細菌叢を持っています。
- 多くの場合、マイクロバイオームの多様性が低下しているため、さまざまな微生物の種類が多くなくなっています。
- 彼らは、付着性侵襲性大腸菌と呼ばれる、炎症を促進する細菌をより多く持っています。
- Faecalibacterium prausnitziiと呼ばれる細菌のような抗炎症細菌も少なくなっています。(Zuo & Ng, 2018)。
炎症性腸疾患の動物モデルでは、マイクロバイオームを変えるだけで、腸内で起こっていることだけでなく、糞便移植によってこれらの動物の免疫系全体を劇的に変えることができます。制御性T細胞とヘルパーT細胞の比率は、炎症に重要なサイトカインと呼ばれる循環化学物質の量と同様に変更することもできます(Kiesler et al., 2015;Shah et al., 2018;Zuo & Ng, 2018)。
また、これらの炎症性腸疾患患者における糞便移植やプロバイオティクスの研究もあり、すべてではありませんが、一部は改善を示しています(Imdad et al., 2018;Kaur et al., 2020)。これらは一般的に非常に小規模で欠陥のある試験であるため、より大きな試験を実施する必要があることに注意することが重要です。
第2節 腸内細菌叢とALS
ALSにおける腸内細菌叢の役割
腸内細菌叢が全身性炎症を調節できることがわかったので、今度はALSにおけるその役割の可能性について見ていきましょう。少なくとも3つのメカニズムが関係しています。
毒素
特定の細菌は、腸に損傷を与える毒素を生成する可能性があります。2005年、Longstrethら(2005)が発表した論文では、クロストリジウムという細菌が毒素を産生し、腸から漏れ出し、運動ニューロンを毒する可能性があるという仮説が立てられました。これは思ったほど突飛なことではありません:Clostridiumは、破傷風と呼ばれる病気を引き起こす毒素を生成することができます。これはまさに運動ニューロンの病気です。しかし、これまでのところ、ALSの正確な理論を裏付ける証拠は見つかっていません。
別の興味深い理論は、ベータメチルアミノアラニン(BMAA)と呼ばれる毒素を含み、これはALSのいくつかのケースで役割を果たしている可能性があります。これはかつて、ALSに罹患するリスクが世界の他のどこよりも50倍ほどあったグアム島で最初に発見されました。しかし、最近ではグアム以外でのALSの原因としても考えられ、藍藻類やシアノバクテリアに由来する可能性があると特定されています(Bradley & Mash, 2009)。この証拠のいくつかは、ALSのリスクが藍藻類でいっぱいの北米の水域の周りではるかに高いように見えるということです(Caller et al.、2009)。実際、この毒素がどのように神経変性疾患を引き起こすかを知ることになるかもしれません。アミノ酸のセリンの代わりにタンパク質に取り込まれているように見えます。現在、BMAAの毒性作用をブロックすることで、ALSを遅らせ、停止、または逆転させるために、L-セリンについて検討する試験が進行中です。
これはマイクロバイオームとどのように関連しているのでしょうか?メライナバクターと呼ばれる細菌の一種があり、マイクロバイオームに存在し、BMAAを生成することができます。しかし、これが人間で起こることはまだ証明されていませんが、人々の腸内細菌叢でこれらの細菌を分離して、BMAAを生成しているかどうかを調べる試みが進行中です。
神経炎症
腸内細菌叢の変化が免疫系を変化させる可能性があることを見てきました。神経炎症がALSに関与している可能性があるという証拠はたくさんあります。ALS患者には、サイトカインの変化、補体プロファイルの変化、ヘルパーT細胞と制御性T細胞の比率の変化、および活性化されたミクログリアがあることがわかっています(Liu & Wang, 2017)。
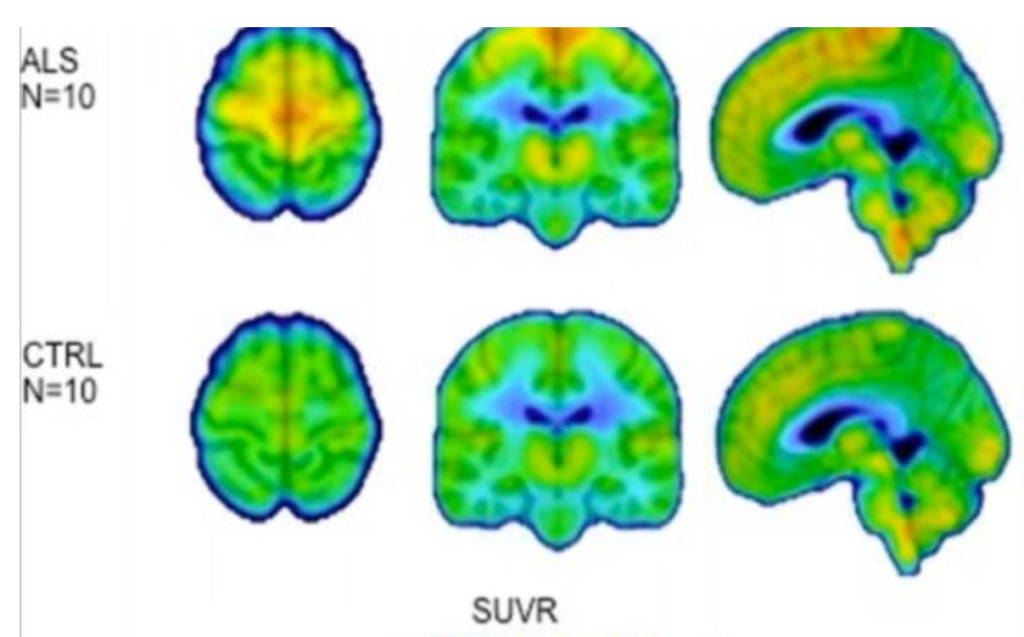
この写真は、マサチューセッツ総合病院のアタッシ博士のグループからのものです。これはPETスキャンで、実際には、上の写真でALS患者10人、下の写真でALSのない10人のPETスキャンを数回行った平均値です。
これらの人々には、活性化されたミクログリア細胞のみに反応するトレーサーを注射しました。反応するトレーサーが多ければ多いほど、画像は熱くなり赤にシフトします。ここでわかるのは、ALSの人は、そうでない人よりもミクログリアの活性化がはるかに多かったということです。この神経炎症を調べることは、現在、ラブリズマブ(ウルトミリス)試験やヒーリーALSプラットフォーム試験などと同じような新しいALS試験法であり、非常にメジャーなターゲットとなっています。これには神経炎症の調査が含まれており、スタンリー・アペル博士は制御性T細胞の数を増やす治療を試みています。
しかし、この神経炎症の引き金は何でしょうか?それはマイクロバイオームの変化かもしれません。例えば、特定の腸内細菌は、循環するサイトカインやT細胞の組成を変化させる可能性があります(Pandiyan et al., 2019)。 特定の腸内細菌がミクログリアの機能に影響を与える可能性があるという実験的証拠さえあります(Abdel-Haq et al., 2019)。
神経保護物質の除去
ALSは、ニューロンの成長と接続を可能にする分子である栄養因子の喪失が原因で発生すると長い間考えられてきました 。 実際、「 筋萎縮性」という名前はそこから来ています。この病気について最初に書いた神経科医のジャン・マリー・シャルコーは、「筋萎縮性」という用語を使用して、筋肉に関連する成長因子のある種の喪失を示唆しています。 ここでは、ALSの栄養因子の変化を示すいくつかの研究が行われています(Sobuś & Machaliński, 2016)が、これらを操作する試みは成功していません。 ただし、酪酸やニコチンアミドなどの神経保護物質を生成する特定の腸内細菌があることを分かっています。(Bourassa et al., 2016)。 これは、マイクロバイオームが変化してこれらの細菌が死滅し、脳がこれらの物質を失ったままになり、ALSを引き起こす可能性があることを意味します。
ALS患者:マイクロバイオームは異なるのか?
ALS患者と健常者の間で腸内細菌叢の組成を比較した研究のすべてではないが一部では、違いが示されている(Boddy et al., 2021によるレビュー)。
では、なぜ異なる研究でこれらの異なる結果が見つかったのでしょうか?
これが研究が行われた方法ですか?

理由の1つは、研究の実施方法である可能性があります。たとえば、ある研究では特定の種類のALS患者を調べ、別の研究では他のタイプのALS患者を調べています。さらに、対照群(ALSのないグループ)にはばらつきがあります。いくつかの研究では、対照群に同じ世帯の人々が含まれていませんでしたが、病気以外にもマイクロバイオームに影響を与えるものがたくさんあるため、これは重要だと思われます。サンプルの供給源も研究によって異なります。例えば、新鮮な便を使用する研究もあれば、凍結便を使用する研究もあれば、唾液を使用する研究もあります。最後に、サンプルの保管と処理、および実行される分析の種類は、すべて研究ごとに異なる可能性があります。
私たちは間違った問をしていますか?
別の可能な説明は、おそらく私たちが間違った質問をしているということです。おそらく、ALSを引き起こすのではなく、マイクロバイオームは病気が始まった後の進行に影響を与えます。これまでのところ、この疑問を扱った研究は、下のグラフに示されている1つだけです。
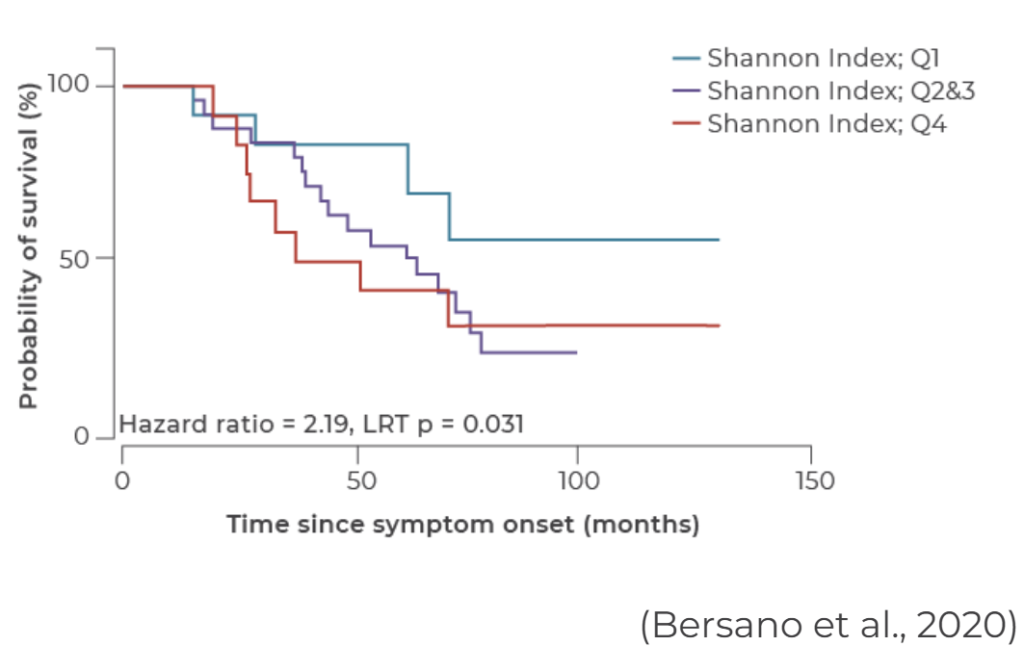
このグラフは、マイクロバイオームの異なる3つのグループの患者の生存曲線を示しています。青い線は、最も単純なマイクロバイオームを持つ人々を表しており、彼らの生存率はより複雑なマイクロバイオームを持つ人々よりも劇的に優れています。
これは、私たちの動物モデルからも当てはまるかもしれないというヒントを得ています。例えば、SOD1とC9orf72のヘキサヌクレオチド反復変異に基づく動物モデルがあります(Wu et al., 2015)。どちらのモデルでも、腸内細菌叢を変えるだけでも劇的な影響を与えることができます。SOD1動物モデルでは、Ruminococcus torquesやParabacteroides distasonisなどの特定の細菌を導入すると、疾患の進行を劇的に加速できます(Blacher et al., 2019;Funabashi et al., 2020)。一方、酪酸を与えたり、Akkermansia muciniphilaのような神経保護細菌を導入したりすると、ALSの影響を改善できます(Blacher et al., 2019;Zhang et al., 2017)。実際、ALSの線虫モデルでは、腸内細菌叢を変えるだけで動物の動きが劇的に変わることが示されています(Labarre, Guitard & Parker, 2017)。
これまでのところ、ヒトのマイクロバイオームを操作しようと試みた臨床試験は1件のみで、RaphaLXと呼ばれるプロバイオティクス製品を評価しました。これは、グルタミン酸合成酵素を産生するLactobacillus plantarumに多く含まれています(Garnaas et al., 2019)。このプロバイオティクスが、人々がグルタミン酸をよりよく代謝するのを助けるかもしれないという考えでした。これは、ALS患者16人が24週間治療を受けた小規模な非盲検試験でした。治療中のALSFRS-Rの進行を、治療前後の進行、および大規模なデータベースからの過去の対照と比較しました。2人の患者では治療中にALSFRS-Rスコアが改善し、3人の患者では治療中に低下はなく、3人の患者では治療中の低下速度が緩やかでした。サンプルサイズが小さいこと、無作為化の欠如、盲検化、プラセボ対照などはすべてこの研究では限界となっています。この試験をサポートした会社は、より大規模なフェーズ2試験を行うことを計画しています。
第3節 デューク大学で行われている研究
クルクミンによる腸内細菌叢の変化

ポリフェノールの化学クラスに属する鮮やかな色の物質

いくつかの異なる植物によって自然に生産されます。

ターメリックやカレー粉などのスパイスにごく少量含まれます。
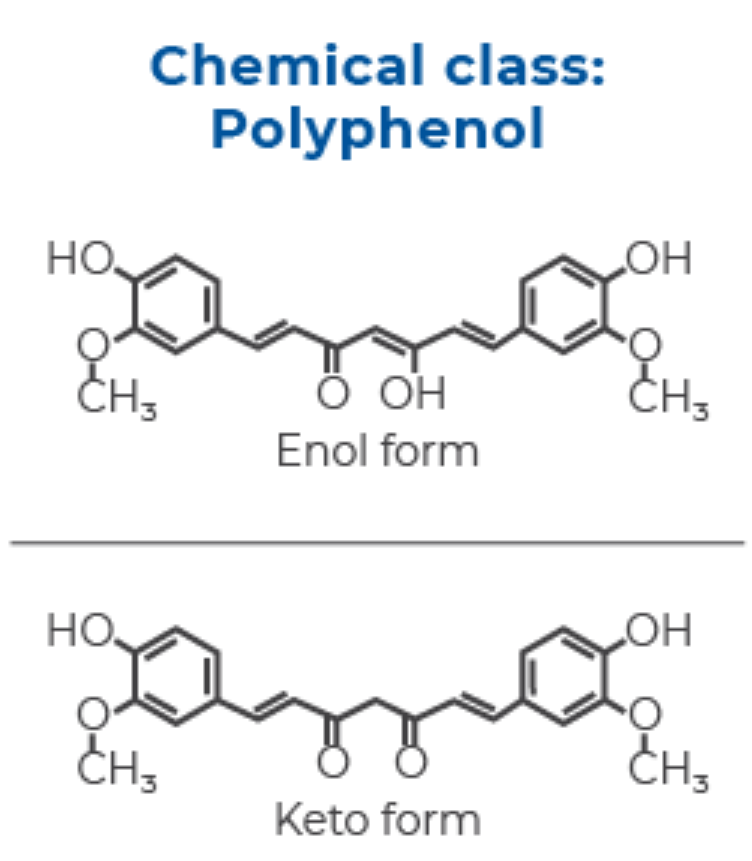
クルクミンの化学構造は、有機溶媒中にあるか水中にあるかによってわずかに異なります。
私たちは、マイクロバイオームを操作するための別の方法を模索する試験が進行中です。これは、テラクルミンと呼ばれるサプリメントを使用しています。これは、ALS Reversals(ROAR)のレプリケーショントライアルの1つです。セラクルミンは、クルクミンの水溶性形態です。ALS患者に利益をもたらす可能性のあるさまざまな作用機序がありますが、その1つは、少なくともマウスではマイクロバイオームを変化させることができるということです。マウスでは、セラクルミンによる治療により、腸内の酪酸産生細菌のレベルが上昇しました。.また、これらの動物では、循環する制御性T細胞の数も増加しました(Ohno et al., 2017)。
クルクミンの研究の詳細については、ALS Reversalsモジュールをご覧ください。
ALSの進行と逆転における腸内細菌叢の潜在的な役割
ALSの進行が非常に速い人、ALSの進行が非常に遅い人、ALSが逆転する人の腸内細菌叢の組成を比較する研究が進行中です。結果は2022年末までに発表される予定です。
ALSの逆転がマイクロバイオームに関連している可能性があるというのは、こじつけに聞こえるかもしれませんが、前例があります。特定の腸内微生物は人々をコレラに抵抗性にさせますが、実際にこの耐性を糞便移植で感染させることができます(Alavi et al., 2020)。
ALSの進行の遅さ、またはALSの逆転に関連する微生物や代謝物が見つかった場合、プロバイオティクスを設計し、来年テストします。
第4節 結論と謝辞
謝辞
私たちは皆、このマイクロバイオーム、つまり私たちの健康に影響を与える可能性のある体のさまざまな部分にあるこれらの生物の集まりを持っており、腸内細菌叢が特定の胃腸疾患に関与していることは非常に明らかです。それがALSの発症に関与しているのか、それともALSの進行速度に関与している可能性が高いのかについては、まだ議論の余地があります。さらなる研究が必要である。しかし、良いニュースは、これらの研究が現在、デューク大学やマサチューセッツ総合病院などの複数の場所で進行中であるということです。今後数年間で、ALSやALSの逆転患者に腸内細菌叢がどのような影響を与えているのか、また、マイクロバイオームを操作して病気を遅らせたり、止めたり、逆転させたりすることができるかどうかがわかるようになるでしょう。
謝辞
私はただ、これを読んでいるすべての患者と介護者に感謝したいと思います。あなたがいるからこそ、私はベッドから出て、同じように一生懸命働くことができます。私のチームと私は、あなたから刺激を受け、やる気を起こさせられています。私たちは必死にあなたを助けるものを見つけたいと思っています、そしてあなたなしではそれを行うことはできませんでした。私たちの研究に参加し、さらには資金を提供してくださった皆さんには、感謝してもしきれません。
